Pese a que la familia podrá acceder al fármaco, existe gran polémica en torno a su efectividad. De hecho, desde el gobierno indicaron que esta es la principal razón por la que no es financiado.
El caso de Tomás Ross ha causado gran conmoción nacional luego de que su madre, Camila Gómez, iniciara una caminata desde Chiloé a Santiago que marcaría un antes y un después para la vida de su hijo.
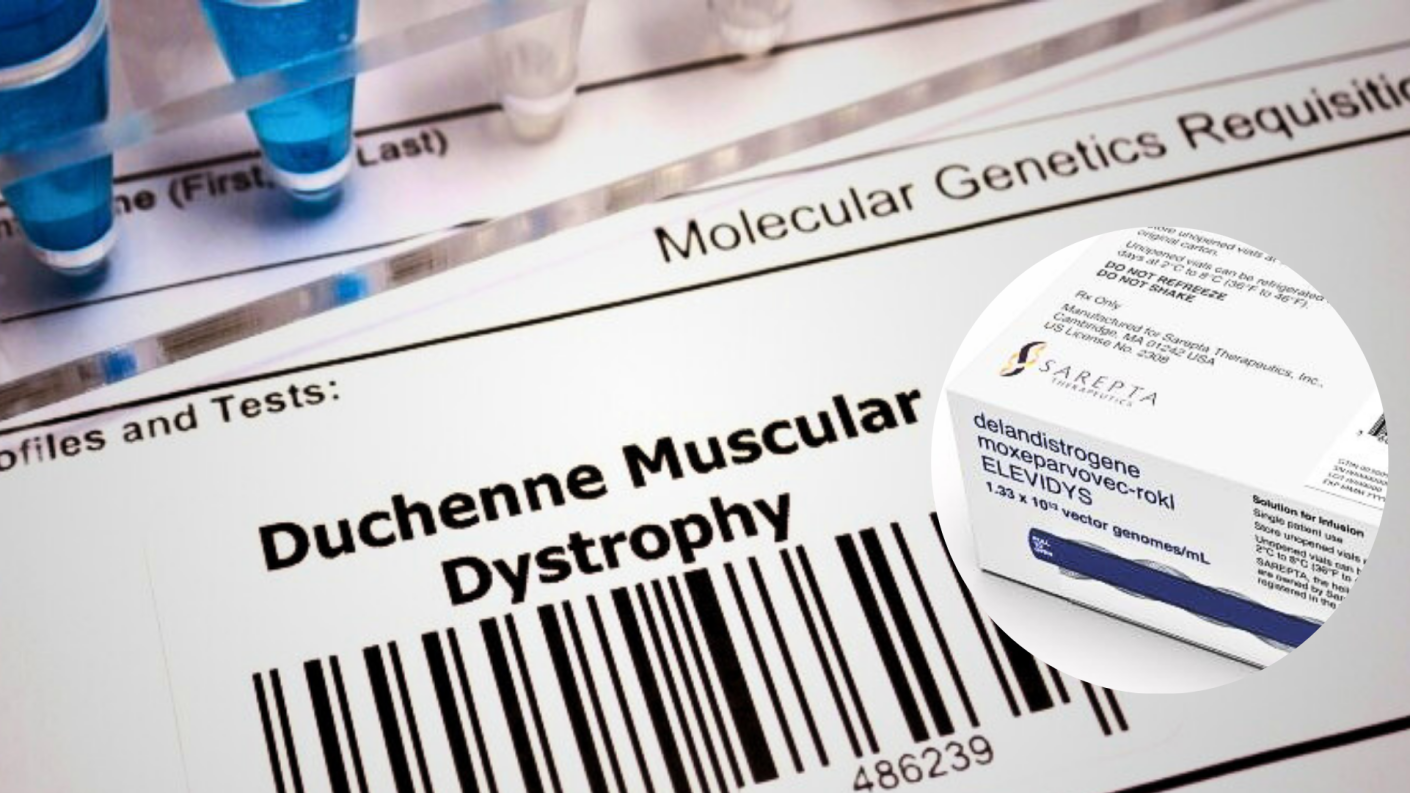
A la fecha, ella dio a conocer que logró reunir los fondos necesarios para comprar el medicamento Elevidys, cuyo valor asciende a los $3.500 millones, que ayudaría a Tomás con su Distrofia Muscular de Duchenne (DMD).
Y pese a que dicha familia podrá acceder al fármaco, existe gran controversia en torno a su efectividad. De hecho, desde el gobierno indicaron que esta es la principal razón por la que no es financiado.
En este sentido, la subsecretaria de Salud Pública, Andrea Albagli, afirmó a El Mercurio que "el Ministerio de Salud tiene que establecer la regulación del uso de productos farmacéuticos y para eso hay varias etapas".
"El medicamento en cuestión no tiene aprobación en las agencias internacionales, y por ende, tampoco tiene un registro dentro del Instituto de Salud Pública (ISP)", aseguró.
De esta manera, puntualizó también la razón que motiva la ausencia del fármaco en el ISP: "Antes de que se pueda instaurar ese registro, y para las posteriores decisiones como, por ejemplo, el financiamiento, tiene que existir evidencia de la efectividad de ese tratamiento, lo cual a la fecha no es el caso", cerró.
"Con incredulidad y molestia leo las declaraciones emitidas por la subsecretaria del Salud Pública del Minsal (...) Lamento profundamente que la persona que hoy está a cargo (...) afirme erróneamente aquello", fue la respuesta que recibió la autoridad por parte del ex ministro de Salud, Enrique Paris, mediante una carta.
"Este medicamento ya fue aprobado por la gencia norteamericana Food and Drugs Administration (FDA) en junio de 2023", señaló sobre las declaraciones emitidas por Albagli.
Luego de las palabras escritas por Paris, un grupo de expertos de las universidades de Chile y del Desarrollo respondieron mediante otro escrito para precisar la información: "Es necesario aclarar que dicha aprobación fue en la categoría de 'aprobación acelerada', la cual permite comercializar productos que aún no han demostrado su eficacia clínica".
"En el documento de la FDA se señala que 'no se ha establecido un beneficio clínico de Elevidys, incluída una mejora de la función motora", suma la carta firmada por Sofía Salas, docente investigadora en bioética de la U. del Desarrollo; Rodrigo Salinas, docente de Ciencias Neurológicas de la U. de Chile; y Juan Cabello, docente de la U. de Valparaíso y U. de Chile.
Asimismo expusieron que "en octubre de 2023, la empresa productora del fármaco dio a conocer que si bien hay resultados favorables en los resultados secundarios, no se alcanzó una diferencia significativa en la función motora de los pacientes".
Ante esta controversia y lo mediática que ha sido la caminata de Gómez, la Federación de Enfermedades Poco Frecuentes (FENPOF Chile) aclaró que "aunque varias personas puedan vivir una misma enfermedad o condición poco frcuente, cada una en sí misma es un mundo diverso que requiere distintos tipos de apoyo y no solo de un fármaco o tratamiento".
"Deseamos que en un futuro cercano se dejen de lado las resoluciones efectistas, pero no efectivas para la población que vive con estas patologías y/o condiciones en nuestro país".
Finalmente, indicaron que por su parte seguirán "trabajando voluntaria y transversalmente por políticas públicas que vengan en beneficio de todas y todos, con el propósito de lograr una mayor equidad y dignidad en salud en Chile".
